
 Par Ulrika Beitnere, Segal Lab, UC Davis.
Par Ulrika Beitnere, Segal Lab, UC Davis.
Il existe une nouvelle sorte de nucléase CRISPR dans la technologie de blocage des gènes, appelée Cas13. Qu’a-t-elle de spéciale et quelle différence y-a-t-il avec la plus connue Cas9 ? C’est une question que se pose, non seulement les parents mais également les scientifiques ! Vous voudriez savoir comment Cas13 peut être utilisée dans le cadre du syndrome d’Angelman et pourquoi cette stratégie devrait être étudiée ? « CRISPR nous apporte un nouveau jeu d’outils à utiliser pour le traitement du syndrome d’Angelman. La nouvelle Cas13 nous permettra de cibler l’antisens à la fois sur le long terme et de manière plus spécifique » affirme le Dr David Segal (UC Davis).
Premièrement, parlons des faits essentiels. Les protéines Cas9 et Cas13 sont deux nucléases (des enzymes capables de couper des ponts phosphodiesters entre les nucléotides d’acides nucléiques). Ces deux nucléases se sont révélées être dirigeables contre presque n’importe quel site dans le génome. La principale différence est que Cas13 cible et coupe l’ARN à la place de l’ADN, ce qui pourrait potentiellement limiter les cibles non-spécifiques. Etant donné que dans le syndrome d’Angelman la cible est le long ARN non codant connu sous le nom de transcrit antisens UBE3A (Ube3a-ATS), éviter de cibler l’ADN est optimal. L’ADN est le script pour toutes les cellules de notre corps, alors que l’ARN fonctionne comme une copie. Corriger la copie fonctionnelle serait plus sûr que muter l’originale. Avec la connaissance des fonctions de l’ARN et de leurs rôles critiques dans les maladies, tout comme le développement des technologies apparentées à l’ARN, il y a un intérêt croissant dans le développement des nouvelles thérapies basées sur l’ARN, tout en évitant les cibles ADN.
Récemment, deux études indépendantes ont utilisé Cas9 pour « réveiller » le gène Ube3a en ciblant une région dans Ube3a-ATS dans des modèles de syndrome d’Angelman chez l’animal. Dans la première étude, Wolter et ses collègues ont utilisé un virus adéno-associé (ou AAV en anglais) pour délivrer Cas9 et ont découvert que Cas9 conduisait l’AAV à s’insérer lui-même dans la région cible d’Ube3a-ATS chez la souris. Un petit rafraichissement – AAV est considéré comme un petit virus sûr déjà utilisé pour délivrer deux thérapies géniques approuvées par la FDA (Food and Drug Administration) : Luxturna pour la dystrophie rétinienne héritée rare, en 2017 et Zolgensma pour l’atrophie musculaire spinale, en 2019. Pour Wolter et ses collègues, Cas9 conduit à une insertion de l’AAV dans la région répétitive de gène Snord115 localisée avant le gène Ube3a (Figure 1A). En ciblant un grand nombre de cibles dans cette région, ils ont pu « réveiller » Ube3a d’origine paternelle dans les neurones.
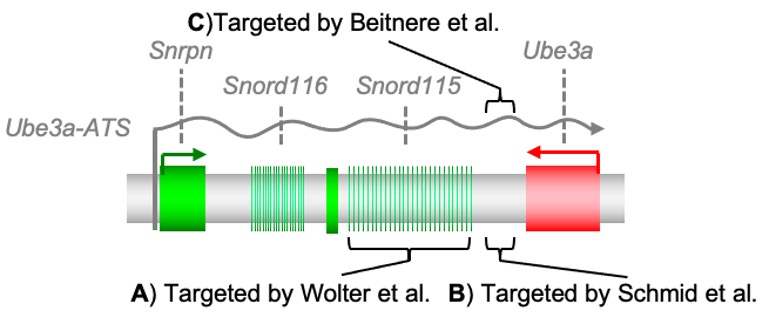
Figure 1. Ciblage des sites dans l’ADN (A, B) et l’ARN (C) d’Ube3a-ATS.
Dans la deuxième étude, Schmid et ses collègues ont également utilisé un AAV pour délivrer Cas9 au niveau d’un site différent du génome, entre la fin d’Ube3a (appelée 3’UTR) et le gène Snord115 (Figure 1B). Contrairement à l’étude de Wolter, ils n’ont pas observé beaucoup d’insertions du AAV, mais plutôt l’introduction de petites insertions et délétions (indels en anglais) d’ADN par Cas9, au niveau du site ciblé. Ces indels interfèrent avec l’élongation d’Ube3a-ATS causant ainsi l’expression durable de la protéine Ube3a originaire de l’allèle paternel. En résumé, ces deux études démontrent que Cas9 interfère avec Ube3a-ATS en créant des cassures double-brin dans l’ADN, dans différentes régions et avec des niveaux d’intégration du AAV variables afin d’activer la copie paternelle du gène Ube3a et ainsi améliorer les signes comportementaux des souris présentant un syndrome d’Angelman. Dans le laboratoire de Segal, nous travaillons dans le même but, mais en ciblant l’ARN et non pas l’ADN, pour lequel il n’y a pas de préoccupation quant aux modifications permanentes de l’ADN.
Cas13 a été utilisée pour cibler l’ARN Ube3a-ATS sans modifier l’ADN (Figure 1C). En utilisant un AAV pour diriger Cas13 directement sur l’ARN d’Ube3a-ATS chez la souris, nous sommes capables de restaurer l’expression d’Ube3a originaire de l’allèle paternel. Plusieurs études sont toujours en cours afin que nous puissions publier nos résultats complets, mais nous sommes très excités quant au potentiel de Cas13. D’autres « drogues ciblant l’ARN » sont déjà testés cliniquement, ou homologuées pour un usage médical : les oligonucléotides antisens (ASO), utilisés dans les essais cliniques sur le syndrome d’Angelman en sont un bon exemple. Cas13 a le potentiel d’être une thérapie idéale pour le syndrome d’Angelman, comme les ASO, mais sans le besoin de répéter les injections intrathécales tous les deux mois (Mend et al. 2015). Pour une autre approche ciblant l’ARN, l’ARN interférent, trois traitements de maladies rares ont déjà été homologués par la FDA, notamment Onpattro (2018), Givlaari (2019) et Oxlumo (2020). Lorsque Cas13 a été comparée à l’ARN interférent, Cas13 a gagné en précision avec zéro cible non-spécifique contre de nombreuses cibles non-spécifiques pour les shRNA (technologie d’interférence ARN) (Abudayyeh et al. 2017, Cox et al. 2017).
D’autres études sur Cas13 encore plus prometteuses pourraient conduire vers des essais cliniques. Début 2020, quand le virus de la COVID-19 se répandait comme un feu de forêt, un groupe de scientifiques a montré que Cas13d pouvait être utilisée comme traitement antiviral en ciblant avec succès l’ARN de la COVID-19 ou des virus influenza A (Abbott et al. 2020). Une autre étude a montré que Cas13a pouvait être utilisée avec succès contre un autre virus, celui de l’hépatite C (Ashraf et al. 2021). La première étude utilisant Cas13 chez l’animal a montré qu’elle était capable d’éteindre l’expression de plusieurs gènes dans le foie avec un AAV comme vecteur (He et al. 2020).
Pour résumer, la nouvelle classe de Cas13 a des spécificités et la particularité de n’avoir aucune cible non-spécifique, la rendant idéale pour les essais cliniques. Avec les approches émergentes de l’activation de gènes au niveau de l’ADN par Cas9, une stratégie ciblant l’ARN avec Cas13 pourrait être avantageuse pour un traitement potentiel du syndrome d’Angelman et nous sommes très enthousiastes de travailler sur ce projet.
Références
Abbott TR, Dhamdhere G, Liu Y, Lin X, Goudy L, Zeng L, Chemparathy A, Chmura S, Heaton NS, Debs R, Pande T, Endy D, La Russa MF, Lewis DB, Qi LS. Development of CRISPR as an Antiviral Strategy to Combat SARS-CoV-2 and Influenza. Cell. 2020 May 14;181(4):865-876.e12. doi: 10.1016/j.cell.2020.04.020. Epub 2020 Apr 29. PMID: 32353252; PMCID: PMC7189862.
Abudayyeh OO, Gootenberg JS, Essletzbichler P, Han S, Joung J, Belanto JJ, Verdine V, Cox DBT, Kellner MJ, Regev A, Lander ES, Voytas DF, Ting AY, Zhang F. RNA targeting with CRISPR-Cas13. Nature. 2017 Oct 12;550(7675):280-284. doi: 10.1038/nature24049. Epub 2017 Oct 4. PMID: 28976959; PMCID: PMC5706658.
Cox DBT, Gootenberg JS, Abudayyeh OO, Franklin B, Kellner MJ, Joung J, Zhang F. RNA editing with CRISPR-Cas13. Science. 2017 Nov 24;358(6366):1019-1027. doi: 10.1126/science.aaq0180. Epub 2017 Oct 25. PMID: 29070703; PMCID: PMC5793859.
Ashraf MU, Salman HM, Khalid MF, Khan MHF, Anwar S, Afzal S, Idrees M, Chaudhary SU. CRISPR-Cas13a mediated targeting of hepatitis C virus internal-ribosomal entry site (IRES) as an effective antiviral strategy. Biomed Pharmacother. 2021 Jan 19;136:111239. doi: 10.1016/j.biopha.2021.111239. Epub ahead of print. PMID: 33454599.
He B, Peng W, Huang J, Zhang H, Zhou Y, Yang X, Liu J, Li Z, Xu C, Xue M, Yang H, Huang P. Modulation of metabolic functions through Cas13d-mediated gene knockdown in liver. Protein Cell. 2020 Jul;11(7):518-524. doi: 10.1007/s13238-020-00700-2. PMID: 32185621; PMCID: PMC7095259.
Hebras J, Marty V, Personnaz J, Mercier P, Krogh N, Nielsen H, Aguirrebengoa M, Seitz H, Pradere JP, Guiard BP, Cavaille J. Reassessment of the involvement of Snord115 in the serotonin 2c receptor pathway in a genetically relevant mouse model. Elife. 2020 Oct 5;9:e60862. doi: 10.7554/eLife.60862. PMID: 33016258; PMCID: PMC7673782.
Konermann S, Lotfy P, Brideau NJ, Oki J, Shokhirev MN, Hsu PD. Transcriptome Engineering with RNA-Targeting Type VI-D CRISPR Effectors. Cell. 2018 Apr 19;173(3):665-676.e14. doi: 10.1016/j.cell.2018.02.033. Epub 2018 Mar 15. PMID: 29551272; PMCID: PMC5910255.
Meng L, Ward AJ, Chun S, Bennett CF, Beaudet AL, Rigo F. Towards a therapy for Angelman syndrome by targeting a long non-coding RNA. Nature. 2015 Feb 19;518(7539):409-12. doi: 10.1038/nature13975. Epub 2014 Dec 1. PMID: 25470045; PMCID: PMC4351819.


