Table des matières
Un webinar a eu lieu le 13 décembre en présence du Professeur Bahi-Buisson afin d’exposer l’essai clinique HALOS qui arrive prochainement en France.
Vous trouverez ci-joint :
- L’enregistrement vidéo avec les nombreuses questions/réponses
- La présentation
- Vidéo explicative sur le fonctionnement d’un ASO
- Des questions/réponses
Webinar enregistré
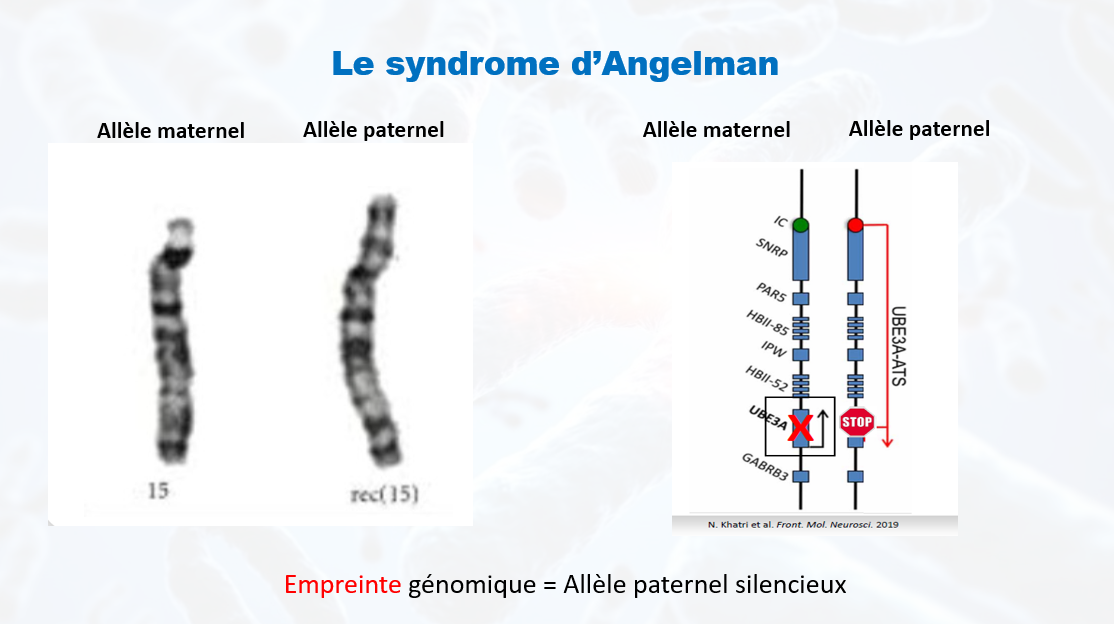
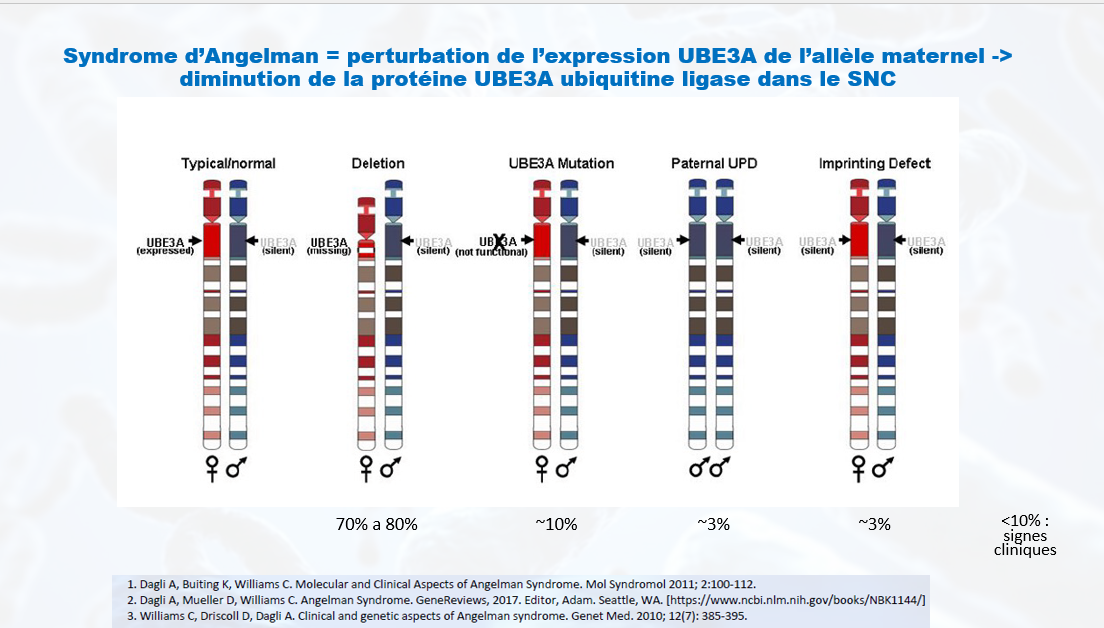
Qu’est-ce que le syndrome d’Angelman ?

Qu’est-ce qu’un essai clinique ?






Qu’est-ce qu’HALOS, essai clinique de phase 1/2 du laboratoire Ionis ?





Vidéo explicative sur le fonctionnement d’un ASO
Les oligonucléotides antisens (ASO) utilisés dans le traitement du syndrome d’Angelman visent à empêcher le gène paternel UBE3A d’être réduit au silence – une condition causée par le transcrit antisens UBE3A (UBE3A-AS). En «renversant» l’UBE3A-AS, le gène paternel devient actif, exprimant l’UBE3A fonctionnel. Les ASO sont délivrés de manière intermittente par une ponction lombaire dans le liquide céphalo-rachidien et, bien que n’étant pas un traitement ponctuel, peuvent être administrés à plusieurs reprises à un patient sur une longue durée.
Foire aux questions
En plus des questions posées lors du webinar, vous trouverez ci-dessous des questions qui reprennent ou complètent le webinar.
Questions sur les essais cliniques
Qu‘est-ce qu’un essai clinique ?
Les essais cliniques sont des études de recherche menées pour en savoir plus sur les effets de nouveaux médicaments. Les études suivent un protocole prédéfini et constituent le moyen le plus important pour les chercheurs pour savoir si un nouveau traitement, comme un médicament ou un dispositif médical, est sûr et efficace pour les personnes.
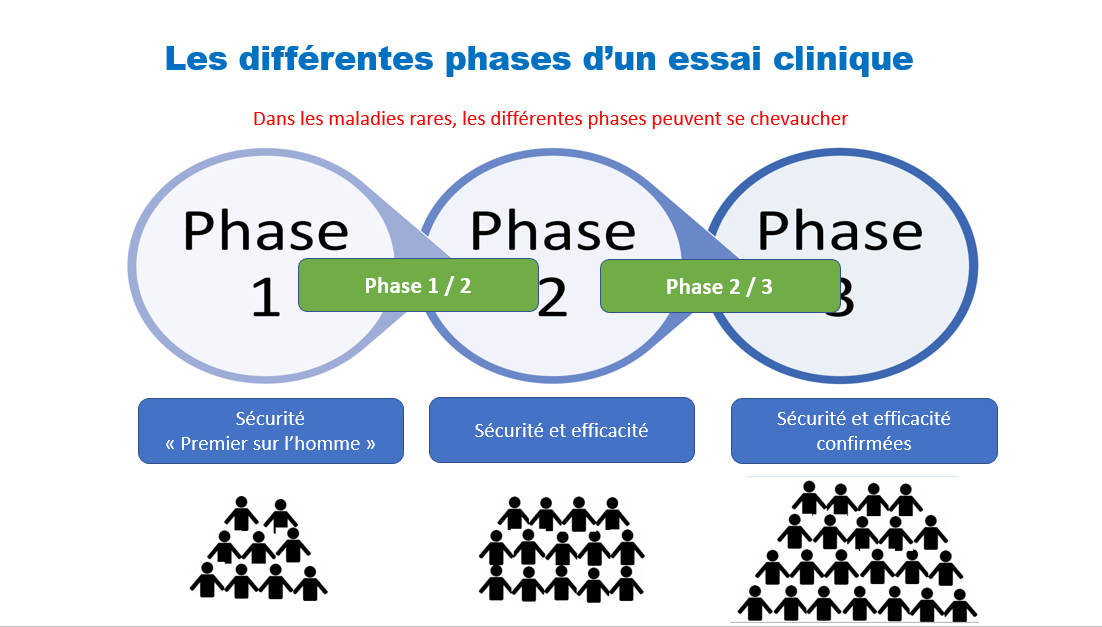
Quels sont les différentes phases d’un essai clinique ?
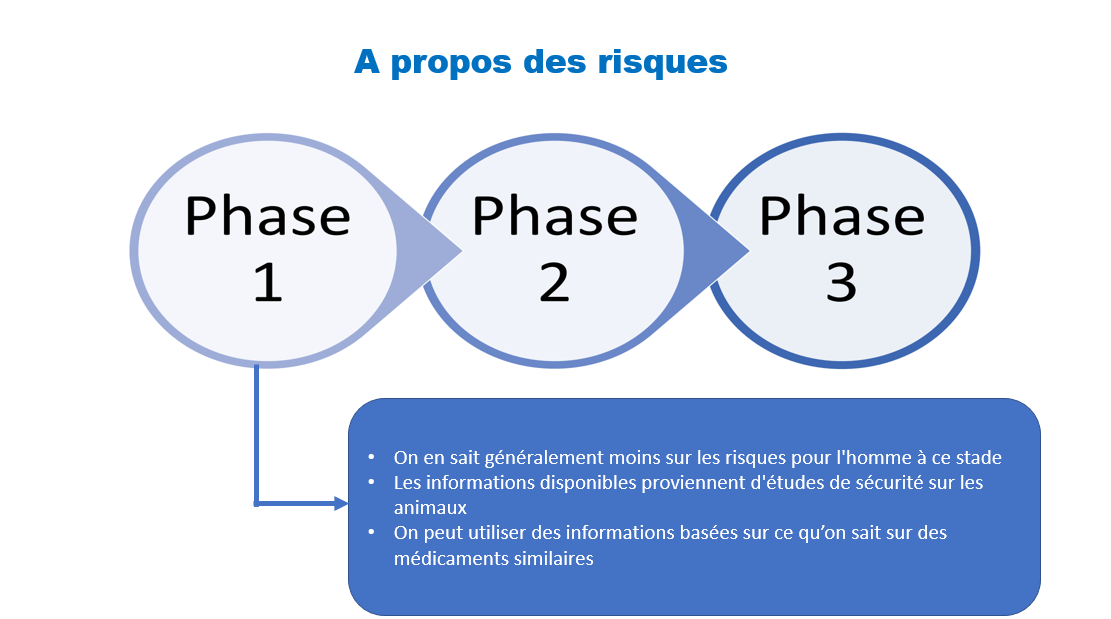
- Les essais de phase I sont la première étape pour tester un nouveau traitement potentiel. Dans ces études, les chercheurs recrutent un petit nombre de patients dans quelques centres et évaluent les problèmes de sécurité, en surveillant de près tout effet secondaire nocif.
- Les essais de phase II incluent généralement un plus grand nombre de patients que ceux de phase I. Le médicament à l’étude ou un traitement est administré à un groupe plus large de personnes pour voir s’il est efficace et pour évaluer sa sécurité.
- Les essais de phase III sont des essais multicentriques randomisés et contrôlés impliquant un plus grand groupe de patients. Le médicament ou le traitement à l’étude est administré à ce groupe plus large pour confirmer son efficacité, surveiller les effets secondaires, le comparer aux traitements couramment utilisés, ou un placebo et recueillir des informations qui permettront d’utiliser le médicament ou le traitement en toute sécurité.
- Des essais de phase IV sont menés pour évaluer l’efficacité à long terme d’un traitement. Ils ont généralement lieu après l’approbation du traitement pour l’utilisation standard et le nombre de participants varie en fonction de la maladie et de la manière dont de nombreuses personnes sont généralement touchées.
Pourquoi devrais-je participer à l’essai clinique ?
Les participants aux essais cliniques peuvent jouer un rôle actif dans leur maladie, avoir accès à des nouvelles thérapies potentielles, recueillir des informations précieuses et aider les autres en contribuant au progrès médical.
Est-ce sûre de participer à un essai clinique?
Il y a toujours des risques à participer à des essais cliniques. Cependant, les protocoles des essais cliniques sont soigneusement contrôlés et conçus pour surveiller la sécurité de tous les participants. Les risques et les bénéfices seront discutés avant de rejoindre l’essai afin que vous puissiez faire une décision éclairée.
Pourquoi les placebos sont utilisées dans certains essais et pourquoi est-ce important ?
Les placebos sont utilisés dans les essais cliniques depuis longtemps et ils ont joué un rôle important dans le développement de nombreux traitements médicaux. En utilisant des placebos dans la recherche, les scientifiques ont une meilleure idée de l’impact des traitements sur les patients et si de nouveaux médicaments et approches thérapeutiques sont sûres et efficaces. L’utilisation de placebos peut accélérer l’étude en permettant à l’efficacité du médicament de devenir évidente et mieux comprise dans un délai plus court que sans groupe témoin placebo.
Qu‘est-ce qu’un placebo ?
Un placebo est une substance qui n’a aucun effet et qui est administrée à certains participants lors d’un essai clinique pour mesurer l’effet du médicament de l’étude.
Que se passe-t-il lors du premier rendez-vous (de screening)
C’est l’occasion de vous rencontrer, de recueillir des informations nécessaires auprès de vous et d’effectuer des tests pour vérifier si vous remplissez tous les critères d’inclusion et que vous n’avez aucun des critères d’exclusion.
L’équipe médicale vous expliquera l’essai et répondra à toute question que vous pourriez avoir. Si vous acceptez de participer, il vous sera demandé de signer un formulaire de consentement.
Si je participe à l’essai clinique, puis-je partager ma participation sur les réseaux sociaux ?
Non, vous n’êtes pas autorisé à partager, publier ou divulguer des informations sur l’essai si vous êtes dans l’essai. Les essais cliniques sont conçus pour permettre la collecte impartiale de données. Exposer vos informations en ligne pourraient influencer les autres et entraîner une sur-déclaration ou une sous-déclaration des effets secondaires du médicament expérimental. Si vous avez des questions sur ce qui peut être approprié de partager, veuillez parler avec un membre de l’équipe d’étude.
Est-ce que ça coûte quelque chose de faire partie d’une étude clinique?
Non, les participants n’ont généralement pas à débourser de frais supplémentaires pour les traitements étudiés dans le cas d’un essai clinique.
Quelles questions devrais je poser avant de participer à un essai clinique ?
La participation à un essai clinique est une décision importante. Voici quelques questions à poser lorsque vous parlez à votre médecin ou à des membres de votre famille pour déterminer la participation de votre enfant.
- Pourquoi cette étude est-elle réalisée ?
- Combien de temps serai je dans cette étude ?
- Quels tests ou procédures devrai je avoir fait si je participe ?
- Combien de visites seront nécessaires et combien de temps durent les visites ?
- Aurai-je besoin de quelqu’un pour m’accompagner lors de mes visites ?
- Quels sont les risques et effets secondaires possibles, et quels sont les bénéfices potentiels ?
- Comment ces risques et bénéfices se comparent ils à ceux que j’éprouverais si je ne le faisais pas ?
Que se passe-t-il si je ne réussis pas la phase de screening ?
Il existe de nombreuses raisons pour lesquelles un participant peut ne pas passer l’étape de la présélection. Vous pouvez demander s’il peut être possible de présenter une nouvelle demande à l’avenir ou de sélectionner un autre essai.
Puis-je arrêter ma participation en cours d’essai clinique ?
La participation clinique est entièrement volontaire et on peut quitter l’étude à tout moment pour n’importe quelle raison.
Questions sur l’essai clinique HALOS
Qu‘est-ce qu’HALOS ?
Le but de cette étude de phase I est d’évaluer l’innocuité et la tolérabilité de doses croissantes de ION582 chez les participants atteints du syndrome d’Angelman. Ou des doses croissantes de ION582 administrées dans le liquide cérébro-spinal dans la colonne vertébrale chez les participants atteints du syndrome d’Angelman.
Qui peut participer à l’essai clinique HALOS ?
Toutes les études cliniques ont des qualifications différentes, connues sous le nom de critères d’éligibilité avec des critères d’inclusion tels que l’âge, le sexe, le génotype… mais aussi des critères d’exclusion.
Si je participe à l’essai HALOS, recevrai je un placebo ?
L’essai clinique HALOS est un essai ouvert : cela signifie que tous les participants auront le traitement ; il n’y a pas de groupe placebo dans cet essai de phase 1/2
En quoi consiste la participation à l’étude clinique HALOS ?
Les études cliniques nécessitent généralement une ou plusieurs nuitées à la clinique et peuvent nécessiter plusieurs visites ambulatoires. Le nombre de visites dépend des besoins de chacun étude. Lors de votre séjour à la clinique de recherche, vous subirez plusieurs prélèvements sanguins, examens, ponction lombaire et vérification des signes vitaux.
Quelles évaluations peut-on faire virtuellement pour cet essai ?
Bien que tous les essais cliniques ne puissent pas être adaptés à un mode virtuel, beaucoup peuvent être adaptés et dans le cas d’HALOS, il y a un certain nombre d’examens qui seront réalisés à la maison.
Où puis-je en savoir plus sur HALOS et d‘autres études cliniques potentielles sur le syndrome d’Angelman ?
- Vous pouvez toujours commencer par demander à votre médecin s’il a connaissance d’essais qui pourraient être adaptés pour vous.
- Si vous faites partie d’un groupe de soutien ou de défense des patients, ils peuvent avoir des ressources ou savoir les essais en cours ou à venir.
- ClinicalTrials.gov est une excellente ressource et un registre de tous les essais cliniques en cours et contient souvent un contact d’étude pour plus d’informations.
Qu‘est-ce qu’ION582 ?
ION582 est un médicament antisens expérimental. Il existe plusieurs antisens avec différents médicaments développés dans le cas du syndrome d’Angelman, ils sont légèrement différents, et votre médecin peut vous expliquer un peu plus les différences.
Que fait ION582 ?
Le composé de thérapie antisens (ASO) sera administré dans le liquide cérébro-spinal de la colonne vertébrale pour cibler la copie paternelle du gène UBE3A et permettre la lecture du transcrit qui produira la protéine UBE3A manquante chez les personnes atteintes du syndrome d’Angelman.
Quelle est la différence entre les 3 ASO ?
Chacun des ASO étudiés a une composition chimique différente qui lui permet de cibler le gène paternel à différents endroits.
Questions spécifiques aux essais cliniques en France
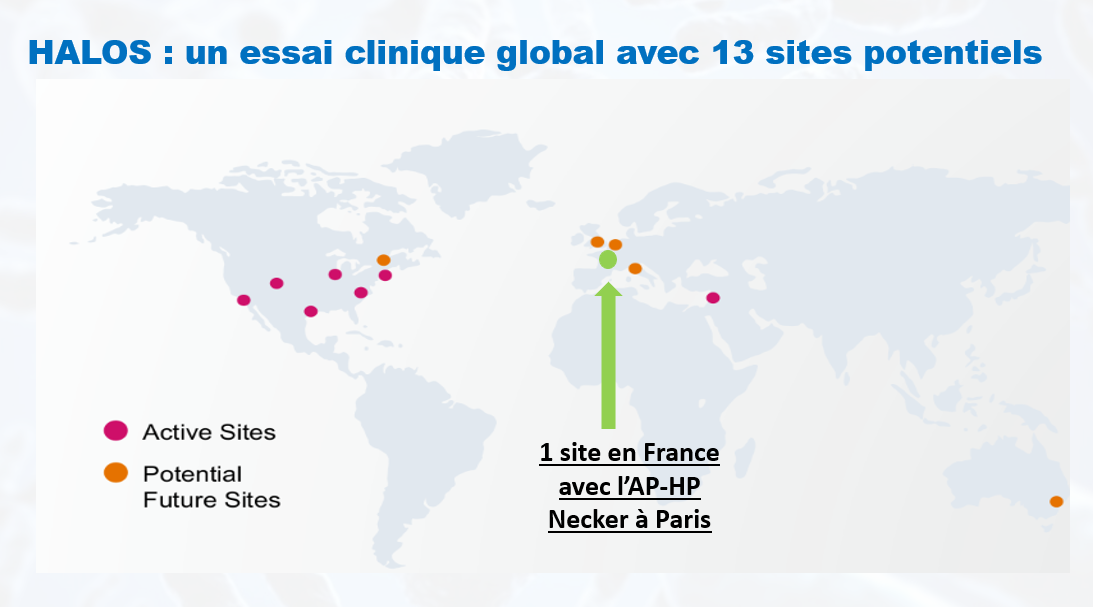
Où est le centre investigateur en France ?
Le site est l’AP HP Necker à Paris.
Comment se fait la sélection des patients ?
- Il faut dépendre de la sécurité sociale française
- Il faut se déclarer intéressé et d’écrire à une adresse mail qui sera fournie courant janvier. Les candidatures seront regardées suivant l’ordre d’arrivée.
- Il faut être éligible : c’est-à-dire respectant tous les critères d’inclusion et n’ayant aucun critère d’exclusion
- Un entretien personnalisé des parents est réalisé par le centre investigateur afin de s’assurer avec eux qu’ils sont prêts à s’engager sur des essais potentiellement invasifs avec une toxicité potentielle et qui peut durer un certain temps
- Mon enfant est sélectionné par le centre investigateur. Je prends le temps de réfléchir à cette proposition. Participer à un essai implique des droits et des devoirs. Après réflexion, si j’accepte pour mon enfant, je signe le consentement.
Ce process est réalisé pour chaque nouvel essai clinique.
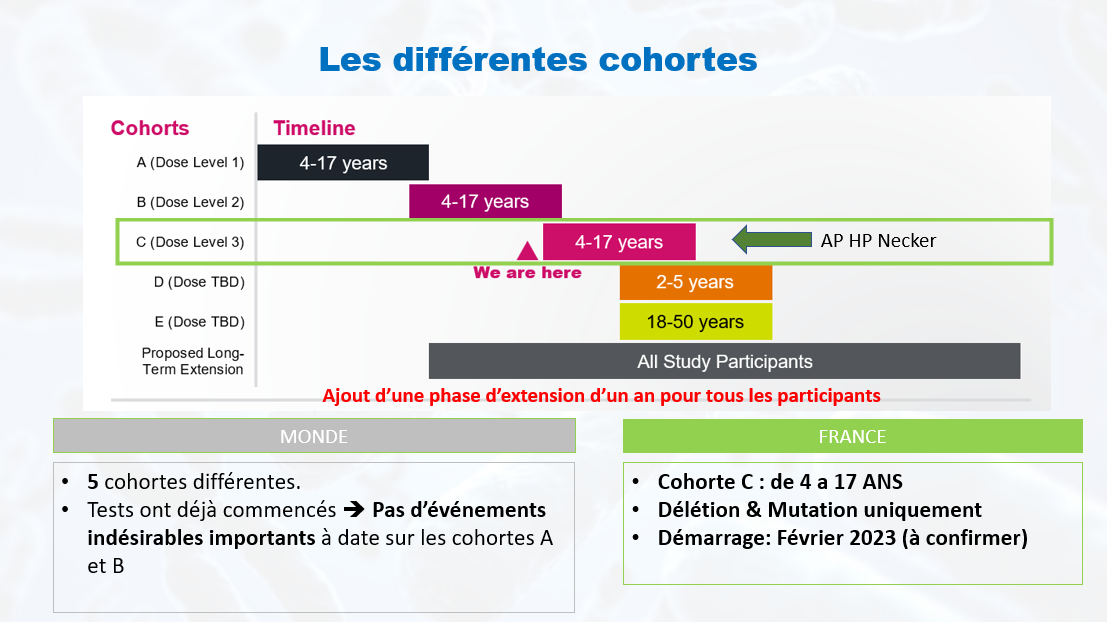
Quels sont les critères d‘inclusion sur l’essai HALOS réalisé en France ?
La cohorte sur laquelle s’est positionnée l’AP.HP Necker est la cohorte C à savoir des âges entre 4 et 17 ans.
Les autres critères d’inclusion sont :
- Homme ou femme entre 4 et 17 ans,
- Diagnostic génétique du syndrome d’Angelman : délétion UBE3A ou mutation UBE3A,
- A un aidant qui peut assister à toutes les visites d’étude et fournir des informations sur les participants.